产业投行:新药火热的今天,回顾史上最大医学灾难
科学的探索,从来都不是一帆风顺,而是螺旋式上升。成功往往是建立在多次失败的肩膀上,有时候还要加上一点点运气。
医学上的发现尤其如此,无论是盘尼西林、伟哥的发现,还是本文的沙利度胺,都上演了“山穷水尽疑无路,柳暗花明又一村”的故事。
沙利度胺本身会导致“海豹胎”(胎儿发育畸形),但是将沙利度胺稍微改造一下,去掉一个羧基,加上一个氨基,就成了治疗骨髓瘤和淋巴瘤的神药来那度胺。2017年,来那度胺的销售额达82亿美元。
最近,大家寄予厚望的几个临床三期的阿尔兹海默试验都失败了。然而,正是这些失败又让人们重新开始审视阿尔兹海默的发病机理,我们有理由相信,未来有一天,我们在攻克阿尔兹海默这个堡垒上一定会取得突破。
在科学面前,唯有尊重数据。如果我们为了利益企图掩盖事实真相,只会像沙利度胺那样,上演人间悲剧。正视失败,分析其后的原因,成功迟早到来。
“沙利度胺(反应停)事件”是现代医学史上最大的灾难。
这个用于孕妇止吐的药物在上个世纪中旬犹如恶魔一般,摧残了数以万计的胎儿,全球范围内因此产生了1万余例畸形“海豹儿”。
令人感叹的是,事后一系列的意外发现和科学研究,又让沙利度胺完成了从魔鬼到天使的华丽转身。
沙利度胺不但促使了药物监管的变革,还造就了著名的制药公司Celgene和全球销售排名前五的重磅炸弹药物来那度胺。其致畸形机理曾经是科学界的一个谜,相关研究促进了免疫、抗炎、血管生成抑制剂、抗肿瘤药物的发展。
发现沙利度胺有害成分只是分子中的一个手性异构体,引起人们对药物中手性现象的重视,间接推动了手性技术的发展。沙利度胺还推动了当前炙手可热的蛋白降解技术PROTAC的兴起,可以说是为小分子药物的未来打开了一扇门。
沙利度胺的救赎之路仍在继续,从来没有一个药物有如此丰富多彩的故事,背后的那些人和事都值得我们好好回味。
1
灾难源于
一个优秀药物研发团队的意外发现
关于沙利度胺(thalidomide)的发现,历史上是有争议的。
一说是瑞士制药公司诺华的前身Ciba与纳粹德国合作研究抗生素时第一次合成了沙利度胺。1962年反应停事件后,Ciba当时的研发副总裁专门在杂志《JAMA》上对这一说法进行了辟谣。
比较靠谱的说法是沙利度胺源于德国制药公司Chemie Grünenthal(现在GmbH)的一个意外发现。
战后的联邦德国百废待兴,肥皂制造商Chemie Grünenthal决定进军制药界。1953年左右,他们聘请了Heinrich Mueckter,一个在德国部队研究抗病毒药物的科学家,担任研发的负责人。
Mueckter的助手Wilhelm Kunz在合成抗生素药物时分离到一个副产物。这个奇怪的化合物被做药理的Herbert Keller注意到结构上类似于巴比妥类镇静剂格鲁米特(图1),经过后续的药化和药理研究,一个新的镇静剂沙利度胺诞生了(1)。
沙利度胺不但有镇静催眠作用,还能显著抑制孕妇的妊娠呕吐反应(2)。
此时,科学家们可能仍在为他们的意外发现而庆幸,殊不知一场人类的浩劫已悄然而至。
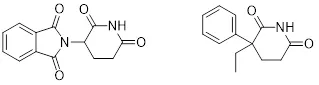
图1:沙利度胺和格鲁米特的化学结构
2
灾难来势凶猛
一时席卷全球
1957年10月,沙利度胺以商品名“反应停”正式投放市场。
基于简单的动物实验,制药公司展开了铺天盖地的夸大宣传,沙利度胺被描述成一个包治百病的“神奇药物”。
特别是,沙利度胺确实能有效减轻孕妇的恶心、呕吐、紧张和失眠等症状。沙利度胺的广告称其为没有任何副作用的抗妊娠反应药物。
不到一年的时间,沙利度胺就风靡全球46个国家,并成为非处方药物,其销量甚至可以媲美阿司匹林。至1959年,仅在联邦德国就有超过l00万人服用过该药物。到1960年,人们注意到世界各地前所未有地出生了大量四肢缺损的先天性“海豹肢症”婴儿(图2)。
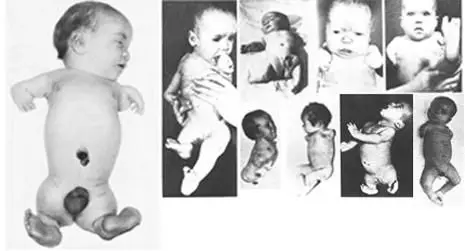
图2:沙利度胺致残的婴儿
现在知道,这正是由于妇女在怀孕初期服用具有强烈致畸作用的药物沙利度胺所造成的。
沙利度胺的第一个受害者是1956年出生的一名没有耳朵的女婴,那时药品还未上市,女婴的父亲正是药品生产商Chemie Grünenthal公司的员工,从内部渠道获得了药物样品。
据统计,沙利度胺事故共造成全球两千多名婴儿死亡,超过一万名严重残疾,流产和轻微残缺的并没有计算在内。
这个事故是一个不折不扣的人间悲剧,其中有意外,但也有许多人为因素,包括科学家的不严谨、药品生产商的虚假宣传以及监管机构的草率等。事后只有部分受害者得到了赔偿,有关官司持续至今。
Grünenthal公司在德国政府的庇护下,也没有得到严厉的处罚。直至2012年,公司CEO在一个致残婴儿雕像揭幕仪式上,才正式向公众道歉,已经整整迟到了50年之久。
3
灾难的拯救
三个医生成为最大英雄

第一个公开警告沙利度胺致畸作用的是一个叫William McBride的澳大利亚产科医生。他在1961年向权威医学杂志《JAMA》写信报告了他们医院4例海豹胎婴儿,母亲均有服用沙利度胺的历史(3)。
与此同时,儿科医生Widukind Lenz,当时是德国汉堡大学儿科的主任,也怀疑到沙利度胺和海豹胎流行的关系,并展开了一些科学研究。1962年,也是在《JAMA》杂志,他向全世界发出了沙利度胺致畸的警告(4)。
起初,制药公司对于这些警告保持了沉默,直到媒体公开报道后,迫于压力,沙利度胺在各个国家陆续撤市。
McBride和Lenz医生无疑成为拯救这次灾难的英雄。而此后两人的人生轨迹却截然不同。Lenz本来就是知名科学家,后来继续研究沙利度胺和生育缺陷,成为一代大家,许多罕见的缺陷都是以他的名字命名的。
说个题外话,他的父亲也是遗传学家,就是臭名昭著的纳粹德国种族优化的理论之父Fritz Lenz,而他的哥哥是提出theorem of Lenz理论的大数学家Hanfried Lenz。
McBride的人生就有点戏剧化了。1962年他第一个揭露沙利度胺悲剧后,被评为当年的年度人物,此后收到了无数的荣誉和奖励。1971年他在悉尼创建了专门研究出生缺陷的研究所Foundation 41,并亲自担任所长。
可能是太渴望复制沙利度胺的成功案例,他又盯上了另外一个治疗妊娠反应的药物双环胺(Debendox),宣称这个药物也有致畸作用。
1980年11月,McBride将他不太靠谱的研究成果投到《Toxicology and Applied Pharmacology》,被拒了,于是他编造修改数据后将文章改投到另一家国际杂志,仍遭拒绝。最后,他只好将造假文章发表在一个不知名的澳大利亚本地杂志上。
这篇文章的共同作者,也是他的助手,在文章发表后发现修改了数据,感到十分不安,于是将他告发了。
经历了数年的调查,这件事碰巧被澳大利亚广播电台的记者得知,公之于众,引发舆论压力,McBride受到严厉处罚,身败名裂,并被吊销了医生执照。
有意思的是,这名记者还挖掘出,当年第一个发现沙利度胺致畸作用的人,其实是医院负责接生的一名护士(midwife), McBride只是抢了别人的功劳写了一封信而已。
不管这件事的真假如何,McBride的人品肯定是有问题,绝不是一个好的科学家。这位老兄吊销医生执照后也不甘寂寞,1994年他又向英国医学权威杂志《BMJ》写信,宣称沙利度胺不但致畸,还可能致突变。他的依据是两个海豹胎患者生下后代,又是海豹胎(5)。
这着实将大家吓了一跳,因为这意味着沙利度胺致残是可遗传的,将会持续影响数代人。好在随后的科学研究发现这是McBride想多了。
诡异的是,正是McBride的这篇胡思乱想的文章,最终导致了多年后沙利度胺致残机理的全面揭示。个中缘由,我们在后面还会提到。
说到英雄,不能漏掉当时拒绝批准沙利度胺在美国上市的FDA工作人员Frances Kelsey医生。
1960年,美国Merrell公司获得了沙利度胺美国销售权,向FDA申请上市。当时才加入FDA三个月的Kelsey医生负责医学审查。她注意到沙利度胺对人有很好的催眠作用,但在老鼠实验中效果却很差,这是否意味着该药物有种属差异呢?而大部分安全性试验来自动物,是否可靠?另外,她还注意到沙利度胺有外周神经炎的副作用,引起手指刺痛。
基于这些观察和判断,她断然拒绝了沙利度胺的上市申请。后来FDA解密资料显示,Merrell公司锲而不舍,先后6次向FDA申请上市,全部遭到Kelsey医生的拒绝,作为一个新人,她承受了巨大的压力。
1962年沙利度胺事件揭露后,Kelsey医生成为美国英雄,肯尼迪总统为其颁发了杰出公民服务奖章。
4
时隔近60年后
科学家才真正解开沙利度胺致畸的谜团
沙利度胺出事后,其致畸机理的研究成为热点。过去半个世纪,前前后后大概有30多种假说,其中比较靠谱有调节免疫、诱导自由基和血管生成抑制剂等理论。沙利度胺真正作用的靶点也是众说纷纭,从DNA、微管蛋白、离子通道到炎症因子等等。但这些研究都不能很好地解释为什么沙利度胺特异性导致海豹胎以及种属差异的现象。
感谢小分子靶点鉴定技术的发展,日本科学家用表面带有沙利度胺类似物的磁珠在细胞提取物中钓到了其主要分子靶点Cereblon (CRBN),2010年这一关键发现发表在《Science》上(6)。
CRBN是体内蛋白质降解机器E3泛素连接酶复合物的一部分。文章进一步显示抑制CRBN影响动物四肢的发育,具体机制不太明朗。找到靶点后,沙利度胺之前众多药理功能的背后机制逐渐被揭示。原来沙利度胺就像分子胶水一样,可以将E3泛素连接酶与各种底物粘在一起。这些蛋白靠近E3复合物后被泛素化标记,而后被溶酶体识别降解。
从2010年起,先后发现沙利度胺及其类似物通过CRBN降解锌指蛋白转录因子Ikaros、Aiolos以及CK1a、ZFP91 and GSPT1等等,这些研究很好地解释了其免疫抑制、抗肿瘤等作用。
至此,如果仔细去读沙利度胺的历史文献,其致畸机理应该呼之欲出了。
这时,我们又要提到拯救沙利度胺灾难的英雄McBride了。之前说到,他1994年向《BMJ》写信怀疑沙利度胺致畸是可以遗传的,因为两个海豹胎患者的后代也是海豹胎。
他的这封信干系很大,当时沙利度胺老药新用的研究正在兴起。其实海豹胎的缺陷不是有了沙利度胺才发现的,百年前就观察到了,可由人体罕见变异造成,包括Holt-Oram和Okihiro Syndrome两种形式。
2002年,英国科学家发现McBride给《BMJ》信件中提到的一个海豹胎父亲其实是Okihiro病人,并鉴定变异的基因是锌指蛋白转录因子Sall4(7)。难道是因为沙利度胺造成了Sall4变异?
2004年,哈佛大学麻省总医院的Lewis Holmes公开发表评论认为不太可能(8)。因为,一个男性尚在胎儿期间,暴露于有害化学物质而在精子中特异性产生表型可遗传的基因变异,几乎不可能。他又分析了64例沙利度胺受害者的后代,没有发现任何不正常。McBride报告的案例可能是先天携带Sall4变异,碰巧其母亲怀孕期间使用了沙利度胺。
无论是McBride,发现Sall4的英国科学家,还是Holmes,当时都忽略了一个今天看起来是如此明显的可能性,那就是沙利度胺也许靶向Sall4,表型复制了Sall4变异。
令人不解的是,即使2010年沙利度胺被发现作用于CRBN而可以降解转录因子,仍然等待了8年之久,科学家才发现Sall4与沙利度胺的关联,从而彻底解开了沙利度胺致畸之谜(图3)。
2018年8月和10月,哈佛大学和Celgene的科学家分别在《Elife》和自然子刊《NCB》发表文章证实了沙利度胺降解Sall4而导致海豹胎(9,10)。而且因为细微的差别,沙利度胺在不同的动物中作用有差异,对老鼠中的Sall4不太敏感。老鼠是最常见的试验动物,这也许是这一谜底姗姗来迟的原因之一。
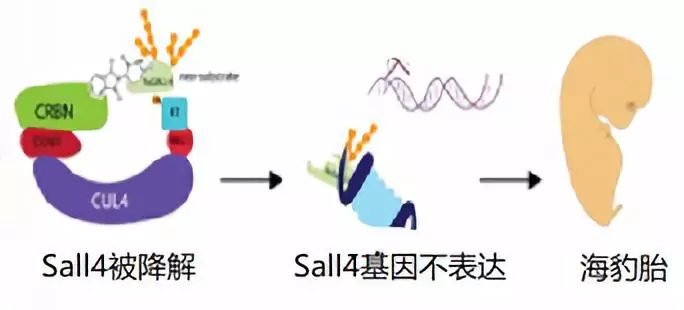
图3:沙利度胺致畸机制
5
又是一个意外
沙利度胺踏上了长达半个世纪的救赎之路
1964年,以色列医生Jacob Sheskin收治了一名麻风病人,伴有严重的结节性红斑。病人非常痛苦,不能行动,彻夜难眠。
当时,沙利度胺被禁已有两年,人们的恐惧之心渐淡。Jacob尝试使用沙利度胺作为病人的安眠药。
令人意外的是,这名病人服用沙利度胺后,不但睡了个好觉,醒来后病情大为减轻,甚至可以起床自由活动。
很快,在WHO的支持下,沙利度胺用于麻风病的临床试验展开,1965年即重新上市。
然而,由于风险管理不当,世界各地仍出现不少海豹胎事故。有数据显示,2005到2010年,在巴西出现了100例以上由于沙利度胺使用不当造成的致残婴儿。
因此,当1998年沙利度胺在美国被批准上市时,FDA要求Celgene公司制定了一个严格的风险管理计划:所有的病人必须登记,提供使用培训,女性要求周期性怀孕检查。
塞翁失马,焉知非福。正是这个看似麻烦的风险管理计划成就了Celgene。沙利度胺是一个没有专利的老药,但这套风险管理系统被Celgene申请了专利保护,因此免遭了仿制药的冲击。
过去几十年,除麻风病外,沙利度胺还曾用于多种其它适应症,包括抗感染、肠道紊乱、抗排斥、关节炎、MS、HIV恶质病等,但最后大放异彩的还是在肿瘤领域。
其实很早就有人尝试用沙利度胺治疗肿瘤,甚至做了一些零星的临床试验,但没有引起人们重视。
后来,沙利度胺类药物成为治疗多发性骨髓瘤(MM)的重磅炸弹,也有点歪打正着的味道。
这还得感谢肿瘤领域里赫赫有名的一个人物,他就是提出肿瘤血管生成理论的哈佛医学院教授Judah Folkman。通过抑制血管生成饿死癌细胞的理论,就像现在的免疫疗法一样,当时也是风光无限。
Folkman于1971年在《NEJM》杂志上发表文章提出实体瘤生长依赖于血管生成。1993年进一步提出血液瘤同样如此,并宣称找到了血管生成的生物标记物。1994年他实验室的成员Robert Amato发现沙利度胺是有效的血管生成抑制剂(11)。
正在此时,一个妇女给Folkman打电话询问血管生成抑制剂,看是否可以挽救她身患晚期多发性骨髓瘤而濒临死亡的丈夫。Folkman说服了这名患者的医生使用沙利度胺,结果效果很好,随后开展了相关临床研究,有三分之一的无药可救的晚期患者产生了应答(12)。
Celgene在此期间,又相继开发了来那度胺(lenalidomide)和帕马度胺(pomalidomide)两个副作用更小的类似物。其中,来那度胺成为年销售超过70亿美元的超级重磅炸弹。
其实,这些药物的作用机理与血管生成的关系不大,主要是免疫抑制和转录因子的降解,这就是制药领域常见的歪打正着。
沙利度胺不久又赐给Celgene另外一个意外收获。沙利度胺具有抑制TNFα的活性,在结构改造时,Celgene发现了活性更好的化合物阿普斯特(apremilast),这个药物最终被FDA批准上市用于治疗牛皮癣。
其实,阿普斯特是一个经典的PDE4抑制剂,作用机理与沙利度胺没有半毛钱的关系。沙利度胺显然成了一座取之不竭的金矿,Celgene挖掘的步伐并没有停止,仍在继续开发新的类似物,最新的肝癌药物avadomide已经进入临床研究(图4)。

图4:Celgene开发的沙利度胺及其类似物
沙利度胺的救赎之路,并不只是出了几个好药,成就了一家公司。
反应停事件至少从两方面对药物发现产生了深刻的影响。
一个是有关药理,种属差异得到重视,监管机构从此改变了药理测试和安全性评价的要求,前面提到的美国FDA的Kelsey医生在这方面做了很多工作。
另一个是有关化学,药物中的手性现象到重视。不同的手性异构体其功能可能完全不同。沙利度胺分子有一个手性中心,后来发现只有S构型才有致畸作用(图5)。
发现这一点也是颇费周折。1967年,美国科学家在《Nature》上发了一篇文章,他们不对称合成了沙利度胺两个异构体,在动物上发现致畸作用没有差别(13)。直到1979年,德国科学家手性分离了两个异构体,动物上发现只有S构型致畸(14)。
这就奇怪了,合成和分离两种方法得到的化合物不应该有差别。后来的PK研究才发现,原来在体内无害的R构型可以慢慢转变成有害的S构型。美国人做动物试验时是口服给药,而德国人是注射给药,体内转化的程度不一样。
由于反应停事件的高曝光率,这个发现成为手性研究最喜欢引用的经典案例,也推动了手性药物的发展。老药的手性拆分,一度就像现在的氘代药物一样,成了开发新药的捡漏捷径。手性药物的发展又间接促进了不对称合成等手性技术的发展,某种程度上,沙利度胺功不可没。
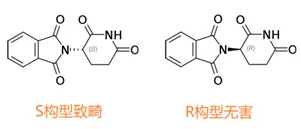
图5:沙利度胺的两个手性异构体
沙利度胺就像一个浪子回头金不换的有志青年,并不满足这些成就,他还想引领未来。
这就要说到当前生物医药领域里炙手可热的小分子新技术PROTAC了。PROTAC是英文Proteolysis Targeting Chimera的缩写,从字面上理解,就是靶向蛋白降解的小分子联合体。
2001年,耶鲁大学的Craig Crews在一篇《PNAS》文章中最早提出了这一概念(15)。他们设计的PROTAC分子一头与目标蛋白结合,另一头与E3泛素连接酶结合,目标蛋白靠近E3复合物后被泛素化(Ub)标记而降解。
听起来熟悉?没错,这与2010年日本科学家发现的沙利度胺分子胶水的工作原理完全一致。也就是说沙利度胺其实是一个无意中被发现的最简单的PROTAC分子。
PROTAC这项技术2001年被提出后,由于各种技术障碍,进展十分缓慢。直到2015年,诺华的研发负责人James Bradner,当时是哈佛的教授,在《Science》上发表新一代基于沙利度胺类似物的PROTAC分子,引爆了整个领域(16)。
PROTAC分子有别于传统小分子药物,通过蛋白降解,可以靶向难以成药的靶点,甚至克服耐药性等难题,因此迅速成为风投、制药公司和学术界的新宠。目前,进展最快的PROTAC分子已经进入临床研究,能否开创小分子药物的未来,我们拭目以待。
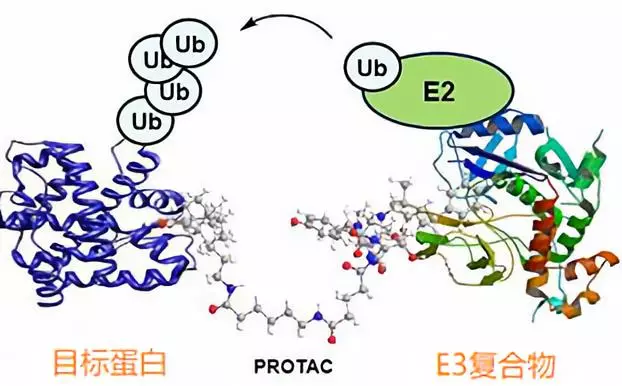
图6:PROTAC工作原理
沙利度胺还会给人们带来惊喜吗?答案是肯定的。
就在两周前,《Science》发表哈佛大学科学家最新的研究成果(17)。他们发现沙利度胺类化合物通过结合C2H2锌指蛋白域(ZF domain)诱导蛋白降解。人类基因表达800多个C2H2-ZF蛋白域,哈佛大学的研究提供了证据,这些蛋白都有可能成为沙利度胺类似物的新靶点。
当然,免疫疗法火热的今天,人们不会忽视沙利度胺类药物的免疫调节功能,他们与PD-1等免疫药物的联用也是热门研究方向,也许不远的将来还有好消息。
6
结语
这两年,国内掀起了一股新药研发的浪潮。让我们所有做药人以沙利度胺为鉴:一个未经考验的新药可以是魔鬼,也可以是天使,就看背后是谎言和贪婪,还是科学和良知。


